Des cancers qui ne tuent plus
Les espoirs fous des nouvelles thérapies
Le cancer est aussi vieux que la vie et son incidence augmente avec l’espérance de vie. À défaut de pouvoir l’éradiquer, les chercheurs espèrent le rendre un jour non létal. Les dernières avancées scientifiques sont porteuses d’espoir.
par Ludivine Ponciau

C’est sur un fragment d’os de pied d’un hominidé du paléolithique ayant vécu il y a 1,7 million d’années en Afrique du Sud qu’une équipe de chercheurs a découvert, chez l’humain, la plus ancienne trace de tumeur invasive visible.
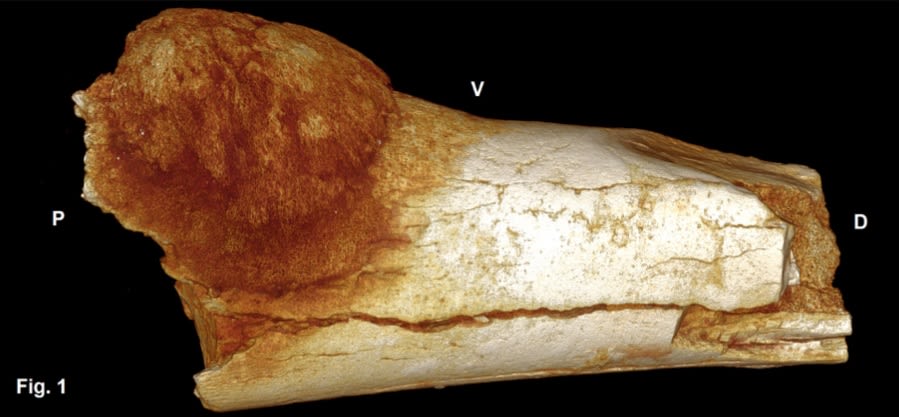
© South African Journal of Science, 112(7/8)
© South African Journal of Science, 112(7/8)
En ces temps reculés, nos ancêtres n’étaient pourtant pas exposés aux facteurs environnementaux néfastes que sont la pollution, le tabac, une mauvaise alimentation ou des rayons UV trop intenses. Alors que le cancer est souvent considéré comme une maladie liée à l’évolution de nos sociétés, à la modernité, la découverte de cet ostéosarcome sur un os enfoui dans une grotte rappelle que « le crabe » est avant tout une maladie aussi ancienne que la vie elle-même.
Mais existera-t-il toujours dans le futur ? Peut-on imaginer que, grâce à la science, les mots « métastases », « récidive » ou « chimiothérapie » finissent par appartenir au passé ? Peut-on raisonnablement concevoir une société dans laquelle on traiterait tous les cancers comme le diabète, l’arthrose ou l’asthme aujourd’hui ?
Ces dernières années, les avancées ont été foisonnantes. Des découvertes spectaculaires et des progrès inédits ont été réalisés, tant dans la compréhension du développement et de la propagation du cancer que dans le dépistage et la prise en charge. La chirurgie et la radiothérapie se font plus précises, les thérapies plus ciblées, l’accompagnement des patients plus personnalisé.
"Faire du cancer une maladie chronique devient un objectif raisonnable"
Michel Goldman, immunologue
« Au début de ma carrière, dans les années 1970, annoncer un diagnostic de cancer à un malade, c’était annoncer une sentence de mort. En outre, la qualité de vie des patients en chimiothérapie était absolument horrible, se souvient Françoise Meunier, oncologue, membre titulaire de l’Académie royale de médecine de Belgique et fondatrice de l’European initiative on ending discrimination against cancer survivors. En cinquante ans, j’ai pu observer toutes ces avancées en recherche fondamentale et clinique dans la plupart des cancers. Aujourd’hui, on peut heureusement affirmer que cette maladie n’est plus forcément une sentence de mort. »
Se demander si on parviendra un jour à gagner la partie contre le cancer n’a pas vraiment de sens pour le Pr Pierre Sonveaux, à la tête de l’Institut de recherche expérimentale et clinique (Irec) de l’UCLouvain, dont de récents travaux portent sur la résistance des cellules tumorales. « C’est un peu comme se demander si on pourra un jour guérir l’infection, alors qu’il en existe de toutes sortes. Le cancer n’est pas une maladie mais un ensemble de maladies. Chez les jeunes individus, il est lié à une anormalité héritée, chez les plus âgés, au fait que le corps est exposé à des facteurs qui agressent et endommagent les cellules, lesquelles se réparent de moins en moins bien au fil du temps. » Ce qui explique que plus nous vivons longtemps, plus nous multiplions les risques de développer des cancers. « L’enjeu de la recherche, aujourd’hui, porte davantage sur la possibilité de lutter contre la mort jeune et d’allonger l’espérance de vie que sur le fait de vaincre le cancer. Un peu comme on le fait avec le VIH », précise-t-il.
« Nous subissons tous des mutations génétiques qui évoluent ou non vers une mutation des cellules, lesquelles migreront ensuite ailleurs dans le corps pour former des métastases. Les individus non malades font de petits cancers, rapidement éliminés par nos cellules. C’est lorsque notre immunité est dépassée que le cancer parvient à se développer », ajoute le Pr Dimitri Leduc, chef du service de pneumologie à l’hôpital Erasme.
"Un monde dans lequel on ne meurt plus du cancer est un objectif atteignable"
Pour Françoise Meunier, si le cancer fera toujours partie de nos vies, nous avons de bonnes raisons de rester optimistes lorsqu’on songe à tout ce que la recherche médicale peut encore nous apporter. « La population vieillit et le cancer est la maladie du vieillissement. Un monde sans cancer est une illusion. En revanche, un monde dans lequel on ne meurt plus du cancer est un objectif atteignable », soutient-elle.
Michel Goldman, immunologue et président de l’institut I3h à ULB, livre le même constat : « Pour les cancers qui ne peuvent être guéris définitivement, repousser au maximum l’échéance et faire du cancer une maladie chronique devient un objectif raisonnable. Pour beaucoup de patients, la situation est comparable à celle des malades atteints de pathologies non cancéreuses comme les maladies rhumatismales ou inflammatoires du tube digestif. On peut espérer qu’à l’avenir, l’annonce d’un cancer signifiera essentiellement qu’un traitement et un suivi au long cours seront nécessaires, sans empêcher le retour à une vie normale ou quasi normale. »
Quand cet objectif pourrait-il être atteint ? C’est évidemment la question à laquelle la communauté scientifique rêve de pouvoir répondre. La recherche prend du temps. Beaucoup de temps. Entre l’annonce d’une découverte et les bénéfices concrets, cinq, dix ou quinze ans peuvent s’écouler... D’ici là, combien auront perdu la bataille ? « Nous récoltons les fruits de ce que nous avons découvert il y a vingt ou trente ans, retrace Pierre Sonveaux. Nous avons aussi amélioré notre qualité de vie à travers l’alimentation ou le sommeil. Beaucoup de choses progressent. Malheureusement, nous restons encore fort démunis pour certains cancers. »
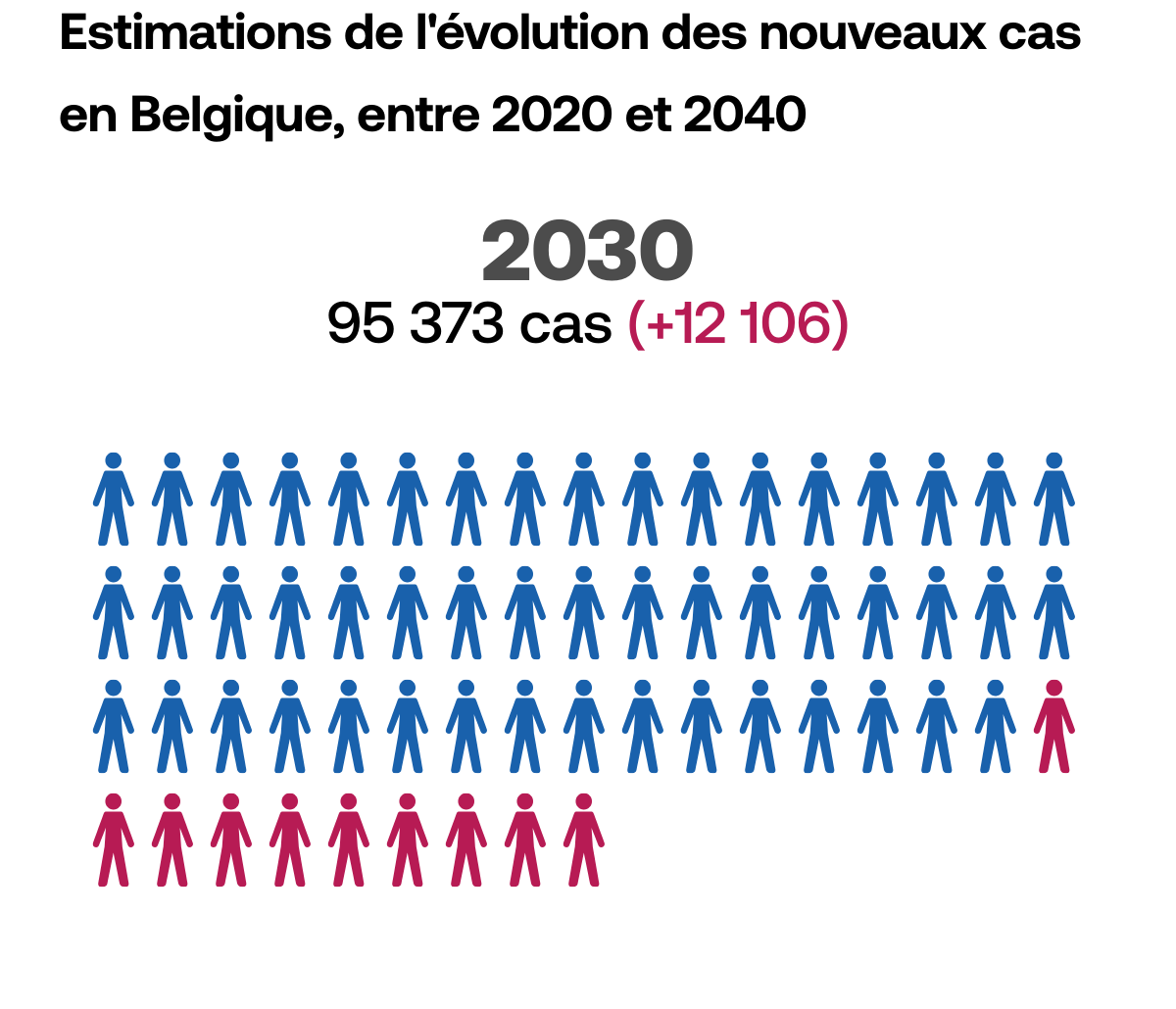
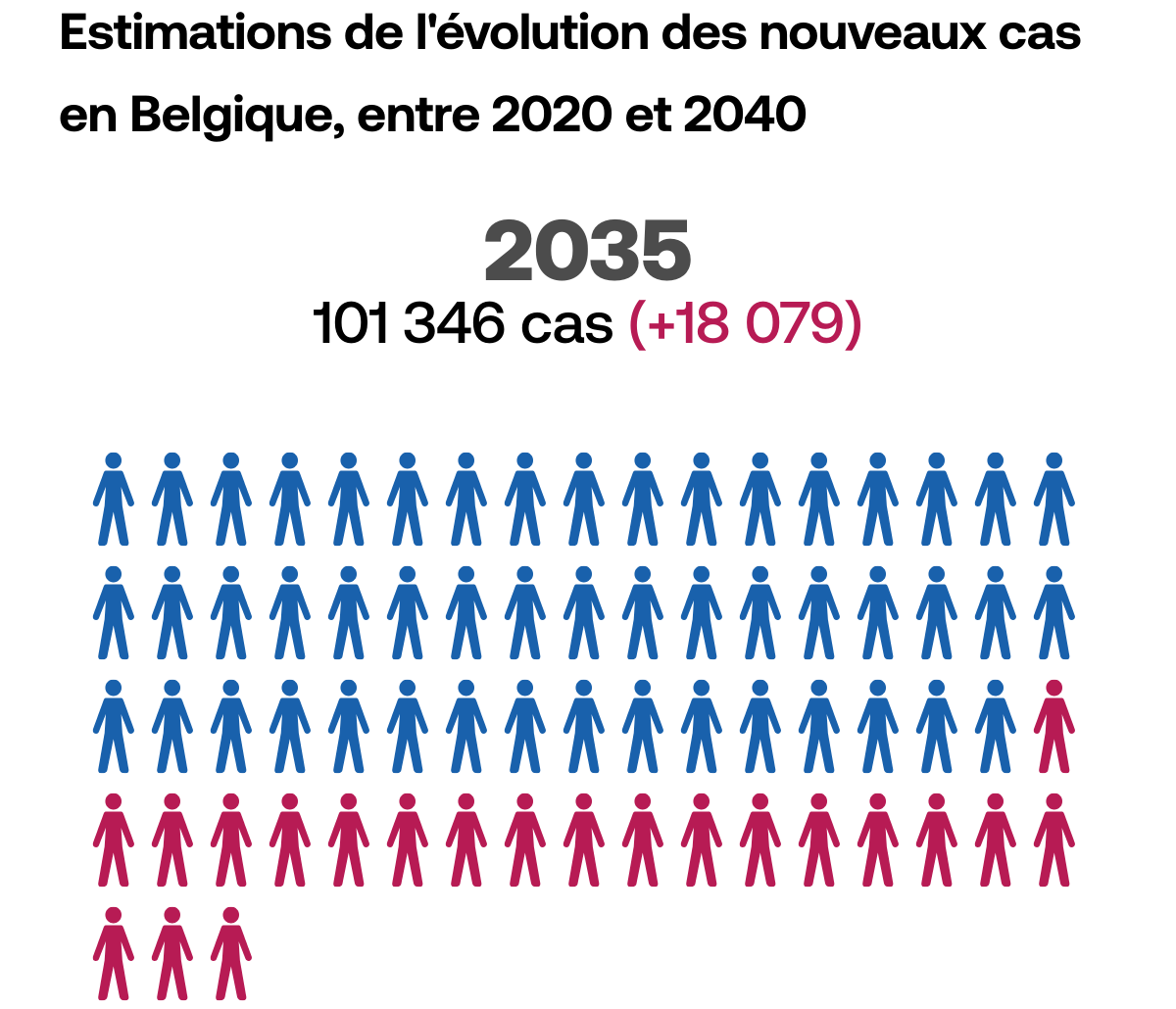

Le dépistage,
un facteur clé

Pour faire en sorte que le cancer ne puisse plus être létal, il faut pouvoir détecter la maladie le plus tôt possible, au stade où les traitements permettent encore de l’éradiquer. Le temps joue toujours en défaveur du patient.
Pour certains types de cancers, notamment ceux induits par des virus, la vaccination permet de limiter considérablement la survenue de la maladie. C’est le cas pour le cancer du foie, lorsqu’il est lié au virus de l’hépatite B. Ou du cancer du col de l’utérus associé au papillomavirus. « On peut imaginer que ces cancers puissent disparaître si on parvient à développer une couverture vaccinale suffisante, évalue l’immunologiste Michel Goldman (ULB). Pour le papillomavirus, nous disposons maintenant de données, issues essentiellement des pays scandinaves, montrant qu’une campagne de vaccination efficace permet déjà de diminuer considérablement l’incidence du cancer du col utérin. »
Pour d’autres cancers, un simple test sanguin permet aujourd’hui de rechercher les anomalies génétiques ou de dépister précocement la présence de métastases. « Dans le cas du cancer de la prostate, par exemple, il est possible de détecter la maladie avant même qu’elle ne commence à poser problème. Il est d’ailleurs tout à fait possible qu’un patient décède de vieillesse avant que le cancer ne se déclare », fait remarquer le Pr Sonveaux. Celui de la thyroïde aussi s’identifie, et se traite, bien mieux qu’auparavant. Voici trente ans, neuf patients sur dix atteints de cette forme de cancer en mouraient. Aujourd’hui, la tendance est inversée.

"Nous récoltons les fruits de ce que nous avons découvert il y a vingt ou trente ans."
Pierre Sonveaux
Institut de recherche expérimentale et clinique (Irec) de l’UCLouvain


Dans le cas du cancer du poumon, étroitement lié au tabagisme, la prise en charge est souvent tardive, ce qui diminue fortement les chances de guérison du patient. À l’heure actuelle, la seule méthode pour déceler un cancer bronchopulmonaire est le scanner thoracique faible dose. Cela permet de réduire la mortalité de 25 % puisqu’il existe davantage de chances que le cancer soit resté localisé, expose le Pr Dimitri Leduc.
D’autres techniques de dépistage du cancer du poumon sont en cours d’élaboration. Elles pourraient déboucher sur une prise en charge nettement plus rapide, et un meilleur pronostic vital. « Nous travaillons sur la possibilité de détecter les mutations de l’ADN responsables de certains cancers au moyen d’une simple prise de sang. Pour le cancer du poumon, le problème rencontré actuellement est que nous ne connaissons pas encore toutes les mutations qui en sont responsables. Si l’on se satisfait d’une biopsie liquide ciblant les anomalies connues, nous risquons de passer à côté. »
Une autre piste prometteuse, insolite à première vue, consiste à utiliser le flair des chiens pour établir un diagnostic. « Un fumeur atteint d’un cancer dégagera un gaz volatile que les chiens sont capables de sentir. Des projets sont en cours pour développer une sorte de nez artificiel », annonce le Pr Leduc.

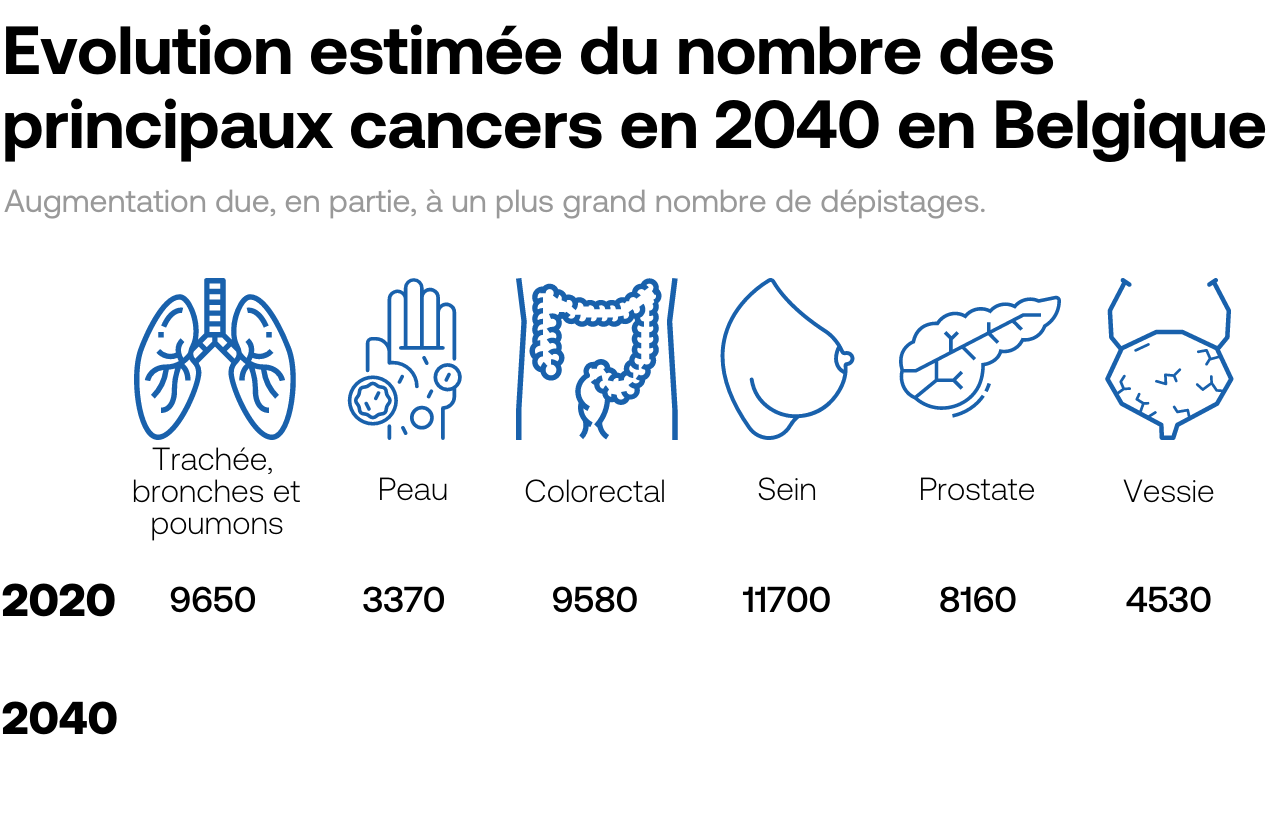
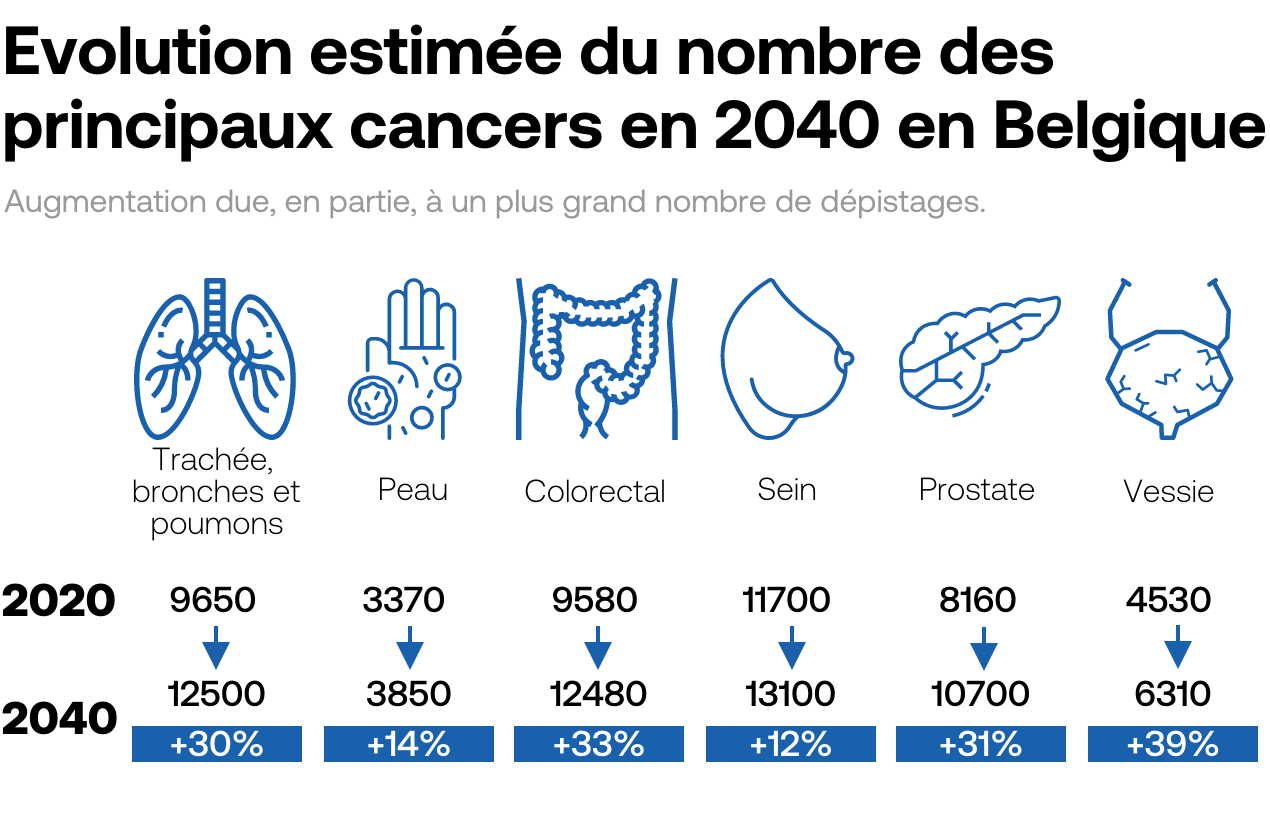
1 cancer sur 3
est attribuable à des facteurs environnementaux (tabagisme, alcool, obésité...)
Dans le cas du cancer du sein, qui touche plus de dix mille femmes par an en Belgique, la biopsie liquide détectant l’ADN tumoral dans le sang pourrait être utilisée pour dépister la maladie, mais aussi pour diagnostiquer plus rapidement la récidive.
Sur ce point aussi, la recherche progresse à grands pas, se réjouit la Pr Laurence Buisseret, oncologue à l’Institut Jules Bordet, où des études cliniques sont en cours pour valider cet outil dans la prise en charge du cancer du sein.
Par ailleurs, dans le cadre du dépistage du cancer par analyse de sang, on s’est aperçu que le test de dépistage prénatal non invasif (NIPT), utilisé pour mettre en évidence les trisomies chez le fœtus, permettait également de déceler des anomalies liées à la présence d’un cancer chez la femme enceinte. Ce qui est très rare, heureusement.
D’autres cancers restent particulièrement difficiles à détecter. Dans le cas du pancréas, le problème est aggravé par la rapidité de l’évolution de la maladie alors que les symptômes, eux, restent diffus. « Le patient ne ressent pas forcément de douleur mais se plaint d’une certaine fatigue et présente un taux d’insuline anormal. Ce sont ces indices qui guideront le médecin vers l’hypothèse d’un cancer du pancréas. Pour ce type de cas, si on pouvait établir un diagnostic sur simple prise de sang, ce serait formidable, évidemment », formule le Pr Sonveaux.
Des symptômes si diffus que le patient ne se rend compte de rien, c’est aussi ce qui explique que le pronostic vital soit toujours aussi sombre pour un autre cancer, celui du cerveau. « Le cancer qui a pour origine le cerveau pousse de façon diffuse. La masse tumorale que l’on découvre chez les patients génère des rayons de cellules cancéreuses qui irradient comme un soleil, décrit le chercheur de l’UCLouvain. On peut enlever la sphère mais il restera les rayons, qui régénéreront une autre sphère. »
« Pour certains cancers, comme celui du sein, nous avons découvert à travers nos recherches plusieurs mécanismes que nous pouvons actionner. Pour le cerveau, malheureusement, on n’en a trouvé aucun. Ce qui pose problème dans ces cas de figure, c’est la récidive », abonde le Pr Blanpain (ULB), spécialisé en médecine interne, investigateur du WEL Research Institute (Welri) et directeur du Laboratoire des cellules souches et du cancer.

Pr Laurence Buisseret, oncologue à l’Institut Jules Bordet
Pr Laurence Buisseret, oncologue à l’Institut Jules Bordet
Avec la quarantaine de chercheurs qui composent son équipe, il tente de comprendre pourquoi certaines cellules souches sont sensibles à la cancérisation alors que d’autres y résistent et d’identifier les propriétés qui contribuent à la résistance de ces cellules.
Mais aussi pourquoi un traitement peut très bien fonctionner sur un patient et pas du tout sur un autre. En mars dernier, dans la revue Nature, l’équipe de l’ULB a publié les résultats d’une recherche sur l’une des principales causes d’échec des traitements par chimiothérapie, l’un des plus utilisés pour vaincre la plupart des cancers. Ils ont découvert qu’une protéine (RHOJ) permet aux cellules cancéreuses présentant une transition épithélio-mésenchymateuse (EMT, processus par lequel les cellules de l’épiderme se détachent de leurs cellules voisines et acquièrent des propriétés invasives) de résister aux traitements anticancéreux en stimulant la réparation des dommages causés à l’ADN par la chimiothérapie.
Elle a aussi mis en évidence le fait que l’expression de cette protéine RHOJ est particulièrement élevée dans les cellules résistantes à la chimiothérapie. Et qu’a contrario, ces cellules deviennent plus sensibles, plus vulnérables, lorsque l’expression de la protéine RHOJ est diminuée. Bien que la découverte soit capitale, il faudra encore attendre que de nouveaux médicaments ciblant la protéine RHOJ puissent être développés et arrivent sur le marché.
Photo by Olga Kononenko on Unsplash
Photo by Olga Kononenko on Unsplash
L’espoir de l’immunothérapie

Chimiothérapie, chirurgie, radiothérapie, thérapies ciblées, hormonothérapie et immunothérapie. Contre le cancer, les stratégies sont multiples. Mais aucune n’est infaillible ou suffisante individuellement. C’est la raison pour laquelle elles sont utilisées de manière combinée. Pour optimiser les chances de guérison, il faut donc non seulement identifier le type de cancer auquel on a affaire mais aussi évaluer à quelle combinaison de thérapies ce cancer pourrait le mieux répondre.
Si des avancées sont régulièrement constatées dans toutes ces stratégies thérapeutiques, c’est dans l’immunothérapie et les thérapies ciblées, dont les anticorps conjugués (anticorps couplés à des chimiothérapies) et la théranostique (traitements radioactifs très ciblés) que chercheurs et médecins placent le plus d’espoirs. L’immunothérapie fait appel à des anticorps monoclonaux, ces produits de la biotechnologie qui permettent de cibler de façon très spécifique des molécules exprimées à la surface des cellules cancéreuses ou des cellules qui empêchent notre système immunitaire d’éliminer ces cellules.«Ils sont sans doute le meilleur exemple du futur de la médecine de précision, s’enthousiasme le Pr Michel Goldman.
Alors que les anticorps que nous produisons naturellement pour lutter contre un virus ou une infection ciblent des antigènes différents, les anticorps monoclonaux ne cibleront qu’un seul antigène. «L’avantage de cette action spécifique, c’est une efficacité et une sécurité mieux garanties», pointe l’immunologiste de l’ULB.
Dans le cas du cancer, les cellules tumorales portent des antigènes qui permettent de les distinguer des cellules normales. Les anticorps monoclonaux vont venir se fixer sur des récepteurs spécifiques présents à la surface des cellules tumorales ou de leur environnement et ainsi les neutraliser.
Leur utilisation est donc réservée aux patients dont la tumeur présente le récepteur ciblé, indique l’Institut national de la recherche et de la santé médicale (Inserm). C’est le cas pour certains cancers hématologiques, du poumon, du côlon, de la vessie, de la tête et du cou, et de certains cancers du sein.

Autre type d’anticorps monoclonaux: les inhibiteurs de checkpoint immunitaire. Leur découverte a révolutionné le pronostic de nombreux cancers, à commencer par le mélanome malin. Comment cela fonctionne-t-il? Notre système immunitaire a la capacité de distinguer les cellules normales des cellules cancéreuses et d’actionner un mécanisme de frein afin que les cellules normales de l’organisme ne soient pas attaquées par les lymphocytes T, ces cellules tueuses qui jouent un rôle important dans la défense de l’organisme.
Problème: les cellules cancéreuses sont capables d’activer ce mécanisme de frein pour pouvoir résister à l’attaque. Grâce aux inhibiteurs de checkpoint immunitaire, on pourra desserrer ce frein et dégrader la cellule cancéreuse.
L’un des avantages de ces inhibiteurs de checkpoint immunitaire? Ils peuvent traiter un grand nombre de cancers: outre les mélanomes, les cancers du poumon non à petites cellules (le plus fréquent), de la vessie, du rein et certains mélanomes. Des études sont toujours en cours pour déterminer leur potentiel exact d’exploitation.
Cette immunothérapie n’est pas systématiquement proposée dans la prise en charge du cancer du sein. Elle intervient surtout pour le sous-type triple négatif au stade précoce mais aussi au stade avancé avec présence de métastases chez les patientes dont la tumeur présente le bio-marqueur ciblé par le traitement. Le sous-type triple négatif représente la forme la plus agressive de la maladie, mais pas la plus fréquente (10% à 15%).
L’expression «triple négatif» signifie que les cellules tumorales n’expriment ni des récepteurs aux hormones (œstrogènes et progestérone) ni le récepteur au facteur de croissance HER2. Avec, pour conséquence, le fait que certains traitements médicamenteux (l’hormonothérapie et la thérapie ciblée anti-HER2) ne seront pas efficaces. «Dans cette maladie, l’immunothérapie par inhibiteurs de checkpoint immunitaire et les anticorps conjugués ont récemment permis d’élargir notre arsenal thérapeutique et d’améliorer le pronostic de ce sous-type plus difficile à soigner», précise le Pr Laurence Buisseret.
Dans les tumeurs solides, la protéine HER2, exprimée à la surface des cellules d’environ 15% des cancers du sein, peut aussi être ciblée par des anticorps monoclonaux (Herceptin) qui viendront inhiber la croissance tumorale.
Autre stratégie d’immunothérapie en plein développement: les CAR-T cells (chimeric antigen receptor T cells), qui visent à combattre le cancer en s’appuyant sur le système immunitaire du patient. Il s’agit en réalité de lymphocytes T qui ont été modifiés génétiquement dans le but de reconnaître et d’éliminer les cellules cancéreuses. La thérapie consiste à prélever des lymphocytes T chez le patient et de les lui réinjecter une fois qu’ils ont été modifiés. L’efficacité des CAR-T cells a été prouvée dans le traitement des lymphopathies B agressives (lymphomes et leucémies) et les résultats sont encourageants pour d’autres cancers, dont les myélomes multiples.

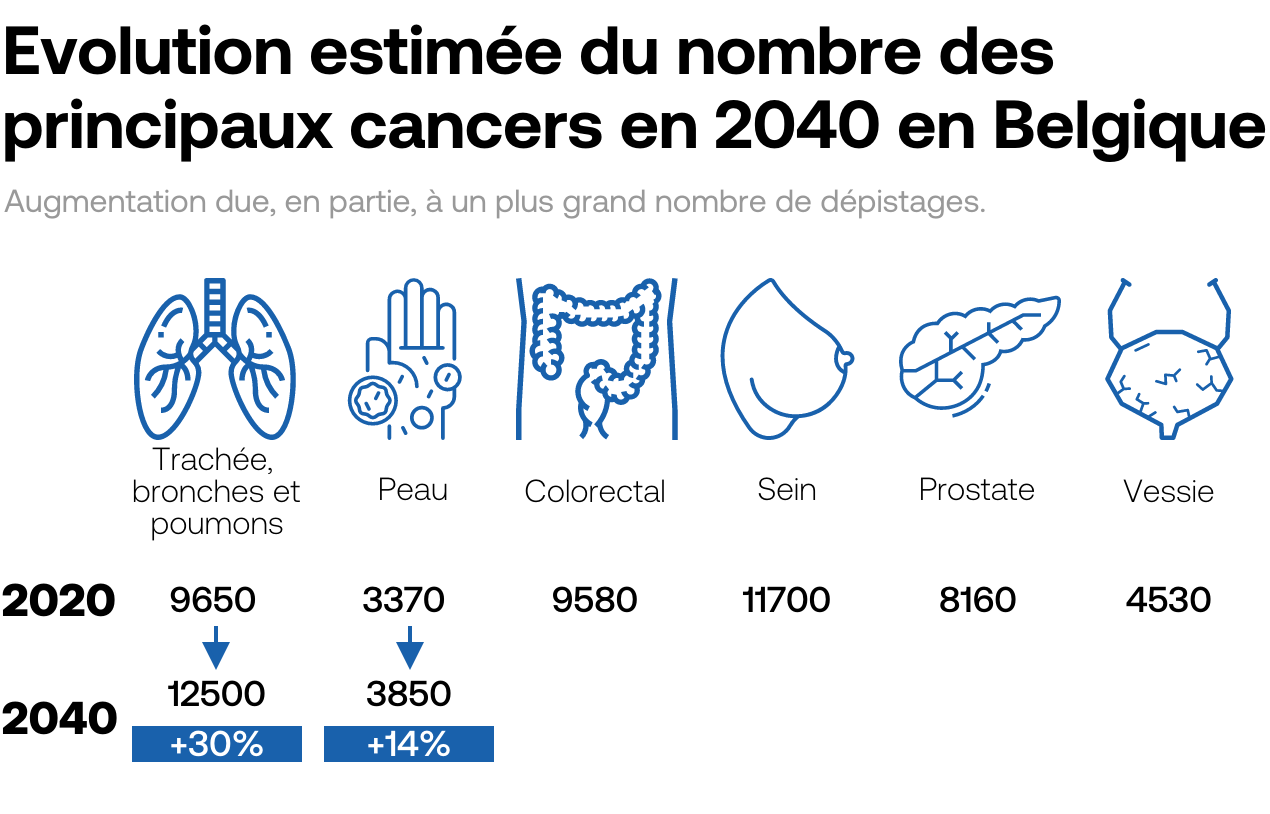
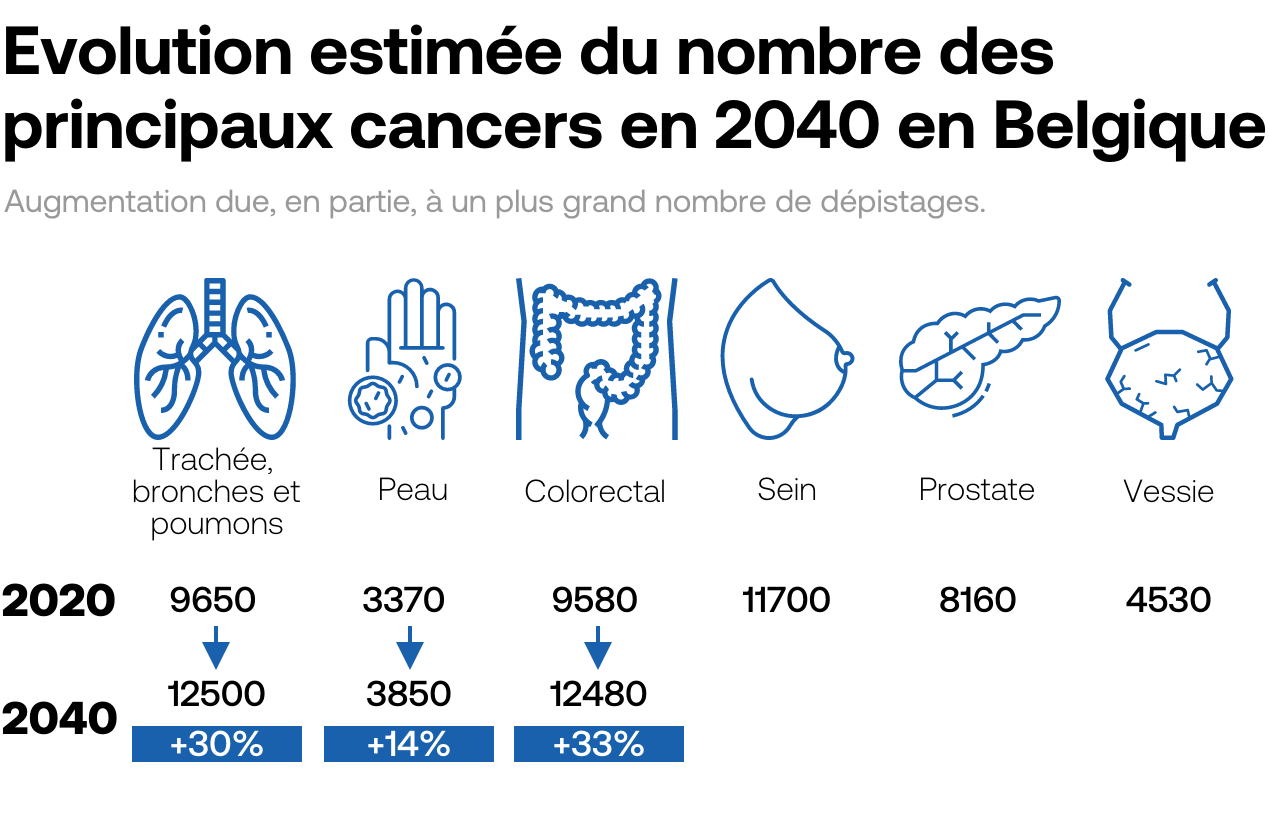
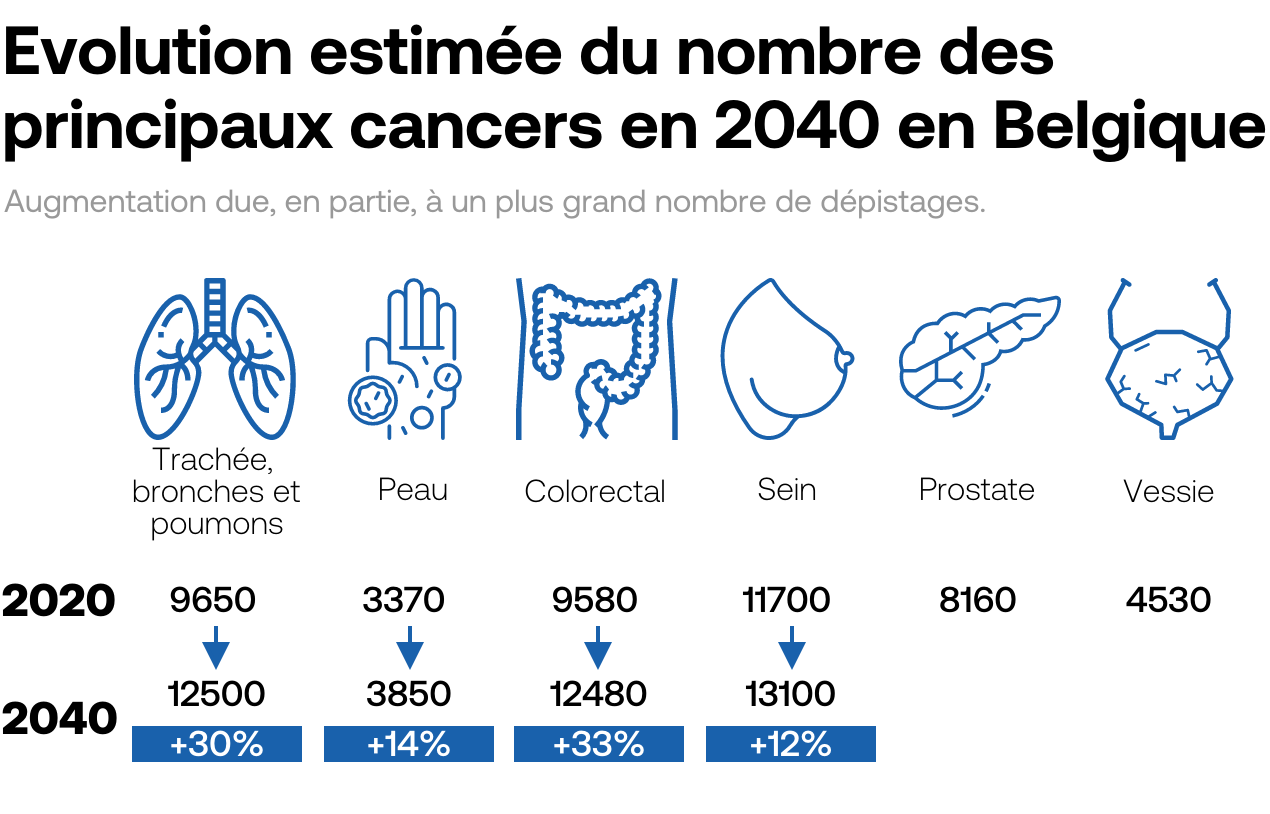
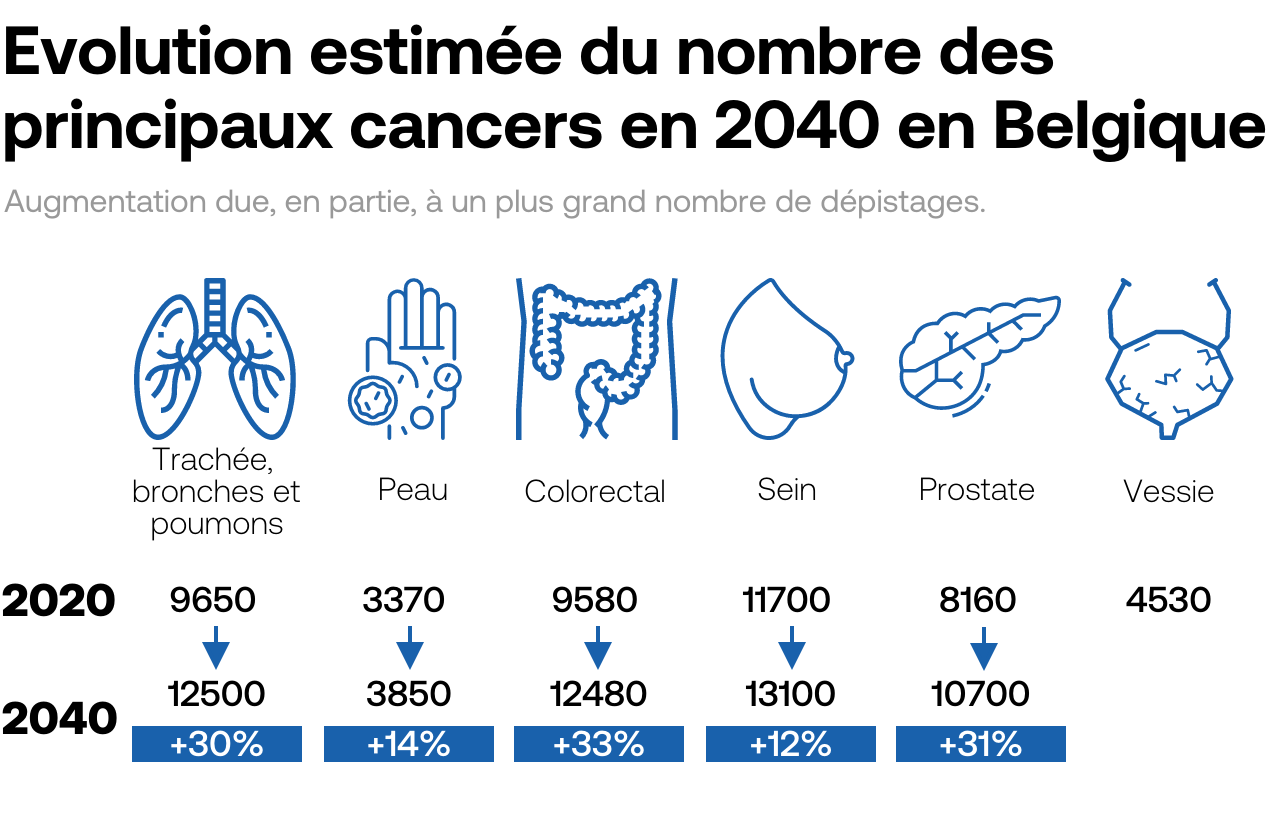
L’immunothérapie n’est pas la seule voie d’avenir. Beaucoup d’espoirs reposent aussi aujourd’hui sur de petites molécules chimiques qui ont l’avantage de pouvoir traverser la membrane cellulaire pour venir bloquer le mécanisme de réparation de la cellule cancéreuse. Autrement dit, les cellules tumorales ont leur matériel génétique endommagé, mais ne peuvent pas le réparer. Ce qui les conduit à une mort cellulaire, aussi appelée «létalité synthétique». Le traitement s’avère particulièrement efficace pour traiter certaines tumeurs du sein et de l’ovaire mutées BRCA 1 et BRCA 2, les deux gènes participant à la réparation de l’ADN, décrit l’Académie française de médecine. Dans le domaine thérapeutique, le développement de thérapies ciblées avec les inhibiteurs de Parp (poly-ADP-ribose polymérase) repose sur ce principe de la létalité synthétique.
Si l’immunothérapie permet de guérir certains cancers, elle a aussi une incidence sur la durée de vie des patients traités. Si l’on se réfère à des courbes de survie de Kaplan-Meier publiée dans Nature (voir graphique ci-contre), on observe une phase de plateau pour les patients ayant été traités à l’immunothérapie. Leurs chances de survie au bout de trois ans sont en effet meilleures que celles de patients ayant été traités avec des thérapies standard.
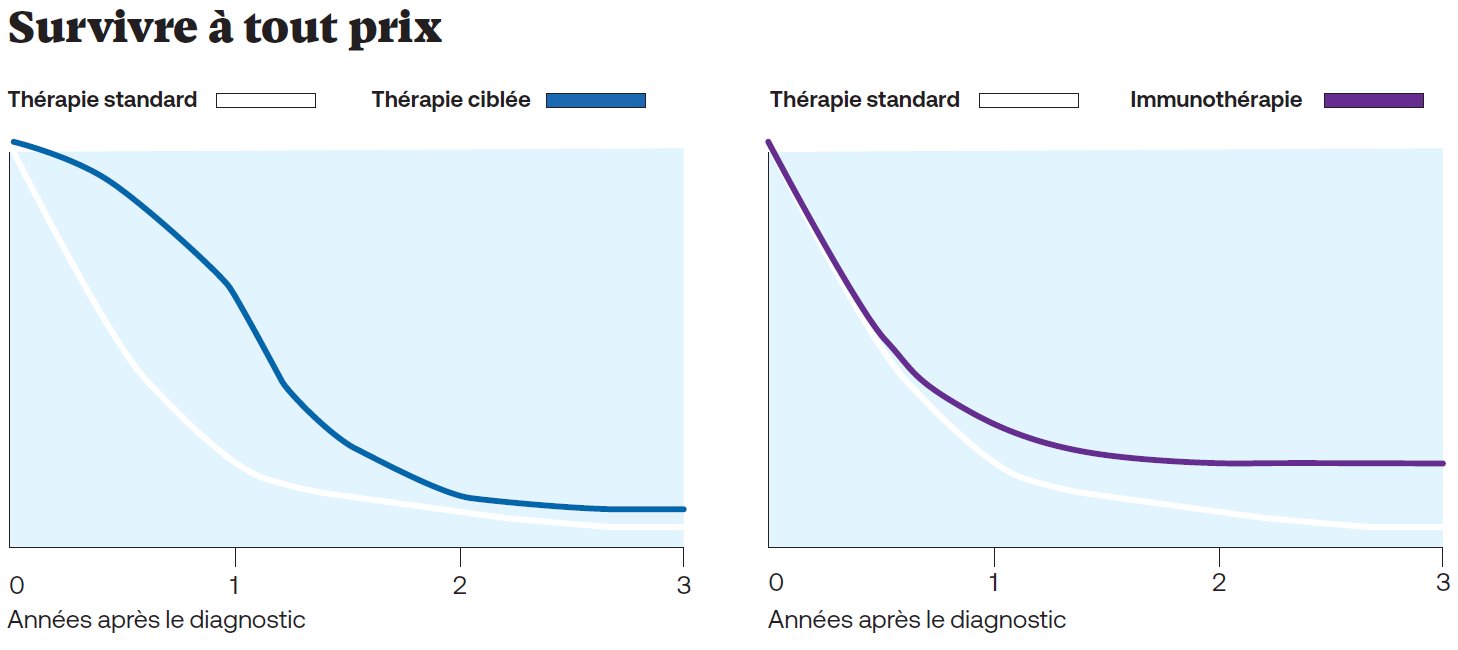
Les patients réagissent généralement bien aux thérapies ciblées (à g.), qui visent des mutations spécifiques d’un cancer, mais seulement pour une courte période. Les inhibiteurs de checkpoint immunitaire (à dr.) n’aident pas autant de personnes, mais celles qu’elles aident ont tendance à vivre plus longtemps. Les oncologues tentent de tirer le meilleur parti des deux stratégies en combinant les médicaments.
Des thérapies inédites

Et ce n’est pas tout. Chaque semaine, ou presque, de nouvelles découvertes sont annoncées, de nouvelles études publiées.
Chez nous, une équipe de l’ULB travaille activement sur les applications possibles de l’ARN messager, le code génétique qui a permis de fabriquer les premiers vaccins contre le Covid-19, dans la lutte contre le cancer.
En décembre 2023, le Pr François Fuks et son équipe du laboratoire d’épigénétique du cancer ont publié, dans Molecular Cell, les résultats de leurs travaux sur le rôle d’un gène clé muté chez plus de la moitié des patients atteints d’une leucémie.
Leur découverte ouvre la voie à une thérapie anticancéreuse inédite.
Quelques mois plus tôt, en mai, les résultats d’une étude publiée dans Nature laissaient déjà présager des avancées significatives contre les cancers du pancréas et les mélanomes, grâce à l’ARN messager.

Le Professeur Francois Fuks.
Le Professeur Francois Fuks.
Parmi les thérapies standard, la chimiothérapie reste une arme précieuse pour faire reculer le cancer, rappelle le pneumologue Dimitri Leduc. «Les traitements systémiques permettent de traiter les cancers à un stade précoce. En passant directement par le sang, on peut tuer les cellules cancéreuses un peu partout dans le corps. Si, par contre, on trouve une tumeur primitive, le traitement chirurgical reste le plus efficace, en combinaison avec la radiothérapie ou des traitements endocriniens.»
L’hôpital Erasme a récemment réalisé une première ablation endoscopique par sonde micro-ondes d’un cancer pulmonaire en Belgique.
La méthode, peu invasive, est proposée comme alternative à la radiothérapie et à la radiologie interventionnelle, aux patients ne pouvant pas bénéficier d’une chirurgie en raison de leur âge, d’une mauvaise fonction respiratoire ou cardiaque.
Nombre de décès dans le monde en 2020
1 800 000
cancer du poumon
916 000
cancer colorectal
830 000
cancer du foie
769 000
cancer de l'estomac
685 000
cancer du sein
"Pour combattre un cancer, nous sommes confrontés à deux gros problèmes: la formation de métastases et la résistance aux traitements"
Cédric Blanpain, directeur du Laboratoire des cellules souches et du cancer
Malgré un dépistage plus précoce, le développement de traitements de plus en plus efficaces et une approche pluridisciplinaire, qui permettent déjà de guérir un patient sur deux en Belgique, les échecs thérapeutiques restent très nombreux.
«De manière générale, lorsqu’il s’agit de combattre un cancer, rappelle le Pr Blanpain, nous sommes confrontés à deux gros problèmes: la formation de métastases et la résistance aux traitements. La cellule cancéreuse est capable de contourner le problème en faisant des mutations ou en acquérant une certaine tolérance aux traitements (NDLR: drug tolerance state), ce qui semble se produire dans de nombreux types de cancers.»
L’un des enjeux aujourd’hui est de comprendre comment diminuer cette plasticité tumorale, la rendre plus susceptible au moyen de l’immunothérapie ou de la radiothérapie. «On ne parviendra pas à développer un seul type de traitement qui puisse fonctionner sur tout le monde. Les cancers sont trop différents entre eux et peuvent évoluer en cours de traitement. Mais nous pouvons prendre chaque cancer individuellement et essayer de comprendre son fonctionnement.» De plus en plus aussi, les organismes de soutien à la recherche, tels que le FNRS ou la Fondation Roi Baudouin, donnent la possibilité aux chercheurs de travailler sur les cancers moins fréquents et dont les traitements seront plus coûteux, comme les cancers pédiatriques.
Vivre avec (et après)
Les cancers qui se soignent le mieux évoluent déjà comme des maladies chroniques. Bien qu’il continue à suivre un traitement et à passer des contrôles réguliers, le patient peut alors mener une vie sociale, familiale et professionnelle presque ordinaire. Une femme qui travaille tout en suivant son traitement pour un cancer du sein ou un homme soigné pour des tumeurs métastatiques qui participe à un tournoi de tennis font partie des nouvelles réalités. À ces malades s’ajoutent ceux qui ne le sont plus. Ceux dont les tumeurs ont complètement disparu, ceux qui ont passé le cap symbolique des cinq ans, au-delà duquel on considère généralement comme moindres les risques de récidive.
Selon les derniers chiffres publiés par la Commission européenne dans le cadre du nouveau Plan européen de lutte contre le cancer, on recense aujourd’hui en Europe douze millions de survivants, dont 300 000 enfants.
Toutes ces personnes comptent. Pourtant, elles se sentent souvent marginalisées ou se voient écartées du milieu professionnel. Parce que la maladie fait peur. Et parce qu’une personne malade ou qui l’a été (et elles seront de plus en plus nombreuses) reste, pour beaucoup d’employeurs et d’assureurs, moins performante.
La médecine progresse mais la société, elle, n’évolue pas assez vite, dénonce Françoise Meunier. À cela s’ajoute la dramatique question de l’accès aux thérapies. D’importantes disparités existent toujours entre les pays de l’Union européenne. Ce qui signifie que l’on meurt plus du cancer dans un État que dans un autre selon la politique d’accès aux soins et de remboursements mise en place. C’est pour lutter contre ces discriminations et promouvoir le droit à l’oubli en matière d’accès aux assurances et prêts hypothécaires que l’oncologue a créé l’initiative Ending financial discrimination against cancer survivors.
Ces discriminations feront aussi l’objet d’une conférence le 15 février 2024 dans le cadre de la présidence belge du Conseil de l’Union européenne.
Texte : Ludivine Ponciau
Enrichissements : Valérie Gay - Christophe Erhat - Thomas Bernard
Images : Getty - Reuters - Unsplash
Mise en ligne : Janvier 2024